Ceftriaxone Sodium for Injection
请仔细阅读说明书并在医生的指导下使用
核准日期:2006年9月26日|修改日期:2022年6月29日
本品与含钙剂或含钙产品合并用药有可能导致致死性结局的不良事件。
成份
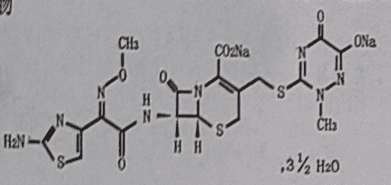
规格
适应症
用法用量
禁忌
注意事项
药理作用
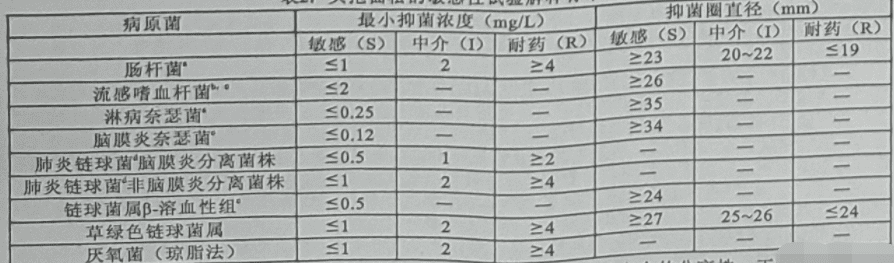
b 对流感嗜血杆菌的敏感性解释标准是基于正常肾功能的患者每 24 小时静注 2 g 而得出的。
c 缺乏耐药菌除“敏感”结果之外的可用数据。如果分离株出现除“敏感”之外的 MIC 结果,则应送至参比实验室进行额外测试。
d 纸片扩散法并不适用与测试肺炎链球菌对头孢曲松的敏感性。然而,距苯唑西林抑菌圈 > 20 mm 的肺炎球菌对青霉素敏感(MIC ≤ 0.06 mg/L)。不能仅依据苯唑西林抑菌圈 ≤ 19 mm 来判定肺炎链球菌对青霉素类(头孢曲松)耐药或中介。
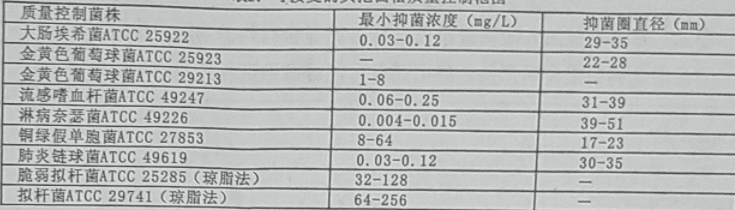
药代动力学
毒理研究
上市许可持有人
生产企业
© 版权声明
特别提醒: 内容为用户自行发布,如有侵权,请联系我们管理员删除,邮箱:mail@xieniao.com ,在收到您的邮件后我们会在3个工作日内处理。
相关文章
暂无评论...

 赣公网安备36020002000448号
赣公网安备36020002000448号